うつ病は気分が落ち込み、何事にも興味や喜びを感じられなくなる病気です。十分な休息と適切な治療で回復できます。一人で抱え込まず、ご相談ください。
心のエネルギーが枯渇し、喜びや意欲を失ってしまう脳の機能障害

- 気分が落ち込み
- 興味や喜びが感じられない
- 睡眠がうまく取れない
- 食欲が落ちる、または増えてしまう
- 体がだるく感じる
- 集中できない、考えがまとまらない
- 不安や焦り、苛立ち
- 自分を責めすぎる
- 価値がないと感じる
- 死にたいと考えることがある
【1】疾患概念・定義(DSM-5-TR / ICD-11)
大うつ病性障害(Major Depressive Disorder: MDD)、通称うつ病は、抑うつ気分または興味・喜びの喪失を中核症状とし、認知、行動、身体症状を伴う、持続的で生活機能に重大な支障をきたす気分障害である。歴史的にはKraepelinによる「躁うつ病」という単一疾患概念から、単極性・双極性の二分論を経て、現代の診断体系に至る。DSM-5-TRでは「抑うつ症群」、ICD-11では「気分症(気分障害)」のカテゴリーに分類される。
DSM-5-TRにおける大うつ病性障害(うつ病)
大うつ病性障害の診断は、大うつ病エピソードの存在によって定義される。
DSM-5-TR 大うつ病エピソード診断基準
A. 以下の症状のうち5つ(またはそれ以上)が同じ2週間の間に存在し、病前の機能からの変化を起こしている。これらの症状のうち少なくとも1つは、1:抑うつ気分、または2:興味または喜びの喪失である。
- その人自身の言葉か、他者の観察によって示される、ほとんど一日中、ほとんど毎日の抑うつ気分。
- ほとんど一日中、ほとんど毎日の、すべて、またはほとんどすべての活動における興味または喜びの著しい減退。
- 食事療法をしていないのに、有意の体重減少、または体重増加、またはほとんど毎日の食欲の減退または増加。
- ほとんど毎日の不眠または過眠。
- ほとんど毎日の精神運動焦燥または制止(他者によって観察可能であるもの)。
- ほとんど毎日の疲労感、または気力の減退。
- ほとんど毎日の無価値観、または過剰であるか不適切な罪責感。
- 思考力や集中力の減退、または決断困難がほとんど毎日認められる。
- 死についての反復思考、特別な計画はないが反復的な自殺念慮、または自殺企図、または自殺するためのはっきりとした計画。
B. その症状は、臨床的に意味のある苦痛、または社会的、職業的、または他の重要な領域における機能の障害を引き起こしている。
C. そのエピソードは物質の生理学的作用、または他の医学的疾患によるものではない。
D. 抑うつエピソードは、統合失調感情障害、統合失調症、統合失調症様障害、妄想性障害、または他の統合失調症スペクトラム障害および他の精神病性障害群ではうまく説明されない。
E. 躁病エピソード、または軽躁病エピソードが存在したことがない。
(出典: American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, Text Revision. 2022.)
ICD-11における抑うつエピソード
ICD-11 (6A70 Depressive episode) も同様の症状基準を設けているが、症状の数と機能障害の程度により軽症、中等症、重症に分類する点が特徴的である。中核症状として「抑うつ気分」と「興味の喪失または喜びの減退」の少なくとも1つを必須とする。
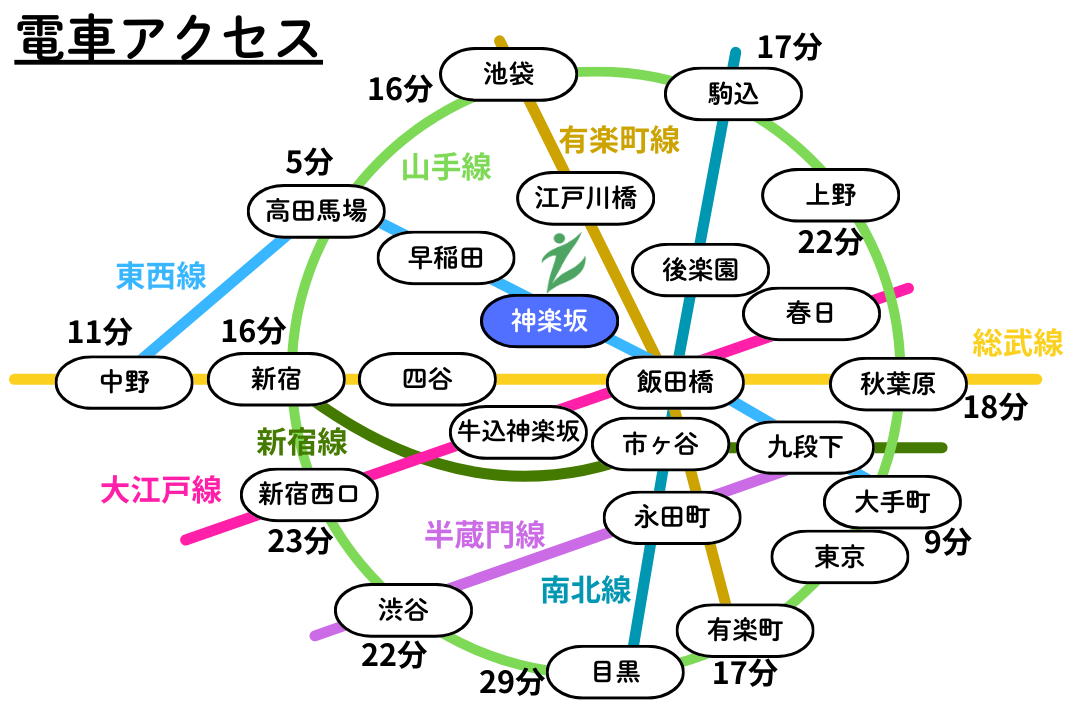
【2】疫学(国内外、有病率、性差、発症年齢)
MDDは世界的に罹患率の高い精神疾患である。2019年の世界疾病負担研究(GBD)によると、うつ病性障害は非致死的健康損失の主要原因の一つである。
- 有病率:
日本の地域住民を対象とした疫学調査では、DSM-IV基準によるMDDの生涯有病率は6.7%、12ヶ月有病率は2.9%であった。世界的には生涯有病率が約17%との報告もある。 - 性差:
ほとんどの国や文化圏において、女性の有病率は男性の約1.5〜3倍高い。自殺企図リスクも女性で高いが、自殺既遂率は男性で高い傾向にある。 - 発症年齢:
発症はどの年齢でも起こりうるが、思春期以降に急増し、20代に最初のピークがみられる。日本では中高年での発症も多い。平均発症年齢は約40歳との報告がある。
【3】病因・病態生理(神経生物学・心理社会的要因)
MDDの病態は多因子性であり、遺伝的素因と環境要因の複雑な相互作用によって発症すると考えられている(ストレス脆弱性モデル)。
神経生物学的要因
- モノアミン仮説:
脳内におけるセロトニン(5-HT)、ノルアドレナリン(NA)、ドパミン(DA)などのモノアミン神経伝達物質の機能低下が病態に関与するという古典的仮説。抗うつ薬の作用機序の基盤となっている。 - 神経可塑性・神経新生仮説:
ストレスによるコルチゾール(HPA系の亢進)の過剰分泌が、脳由来神経栄養因子(BDNF)の発現を低下させ、海馬などの神経細胞の萎縮や神経新生の抑制を引き起こすという仮説。海馬体積の減少がうつ病患者で報告されている (Savitz JB, et al., 2014, PMID:24361541)。 - 炎症仮説:
炎症性サイトカイン(IL-1β, IL-6, TNF-αなど)の上昇がうつ病の病態に関与するという仮説。サイトカインはHPA系を活性化させ、モノアミン代謝に影響を与える。 - グルタミン酸作動性神経系:
NMDA受容体の機能異常が注目されており、ケタミンの迅速な抗うつ効果の機序として研究が進んでいる (Diaz-Granados N, et al., 2010, PMID:20925932)。 - 大規模脳ネットワークの異常:
近年の研究では、安静時機能的MRI(rs-fMRI)を用いて、脳ネットワークの異常が指摘されている。特に、自己参照的な思考に関わるデフォルトモードネットワーク(DMN)の過活動と、外界への注意や顕著な刺激の検出に関わるセイリエンスネットワーク(SN)の機能異常が報告されている。2024年の研究では、うつ病患者においてSNが大脳皮質に占める割合が健常対照群の2倍以上大きいことが示され、内的なネガティブな情報への過剰な同調が病態に関与する可能性が示唆された (Price, R. B., et al., 2024)。
遺伝要因
双生児研究からMDDの遺伝率は約40%と推定されている。双極性障害(約80%)よりは低いが、発症への遺伝的寄与は明らかである。セロトニントランスポーター遺伝子多型(5-HTTLPR)とストレスフルなライフイベントの相互作用が発症リスクを高めるという報告(Caspi A, et al., 2003, PMID:12869766)は、遺伝子-環境相互作用の代表例である。
心理社会的要因
- ライフイベント:
喪失体験、対人関係の葛藤、経済的問題などのストレスフルなライフイベントは、MDDの強力な誘因となる。特に初発エピソードの前に先行することが多い。 - 早期逆境体験 (Adverse Childhood Experiences: ACEs):
幼少期の虐待やネグレクトは、HPA系の機能変化や情動調節の困難さを通じて、成人後のMDD発症リスクを著しく高める。 - 認知モデル:
Beck, A.T.が提唱した認知理論では、自己、世界、将来に対する否定的なスキーマ(認知の歪み)が、抑うつ気分を維持・増悪させると考える。 - パーソナリティ:
神経症的傾向(Neuroticism)が高いパーソナリティは、MDDの脆弱性因子として知られている。
【4】臨床症状・経過(典型例・非典型例)
MDDの臨床像は多彩であり、感情、意欲、認知、身体の各側面にわたる症状が出現する。
- 典型例(メランコリアの特徴を伴う):
精神運動制止、喜びの完全な喪失(アンヘドニア)、早朝覚醒、午前中に症状が悪化する日内変動、過度の罪責感、食欲不振・体重減少を特徴とする。生物学的治療(薬物療法、ECT)への反応性が比較的良好とされる。 - 非定型例(非定型の特徴を伴う):
気分の反応性(良いことがあると気分が明るくなる)を保持しつつ、過食、過眠、鉛様麻痺感、対人関係における拒絶への過敏性を特徴とする。若年発症が多く、双極性障害との関連も指摘される。 - 精神病性の特徴を伴う:
妄想(罪業、貧困、心気妄想など)や幻覚を伴う重症型。気分と一致する内容(mood-congruent)が多いが、一致しない(mood-incongruent)場合は統合失調感情障害などとの鑑別が重要となる。 - 混合性の特徴を伴う:
抑うつエピソード中に、3つ以上の躁症状(気分高揚、誇大性、多弁、観念奔逸など)が同時に存在する状態。双極性障害への移行リスクが高いことが知られ、抗うつ薬単剤治療による躁転に注意が必要である (Koukopoulos, A., et al., 2013, PMID:23680954)。 - 不安性の苦痛を伴う:
不安、緊張、落ち着きのなさ、集中困難などが顕著な場合。自殺リスクの高さや治療反応性の低さと関連する。
経過:
MDDは反復性の経過をとることが多い。未治療の抑うつエピソードは約6〜13ヶ月持続する。寛解後も再発リスクは高く、エピソードを重ねるごとに再発率は上昇し(1回後: 50%, 2回後: 70%, 3回後: 90%)、エピソード間の期間は短縮する傾向がある。約20%が慢性的な経過をたどる。
【5】鑑別診断と評価尺度
診断はDSM-5-TRまたはICD-11の操作的診断基準に基づき、臨床面接を通じて行う。
鑑別診断:
鑑別診断は極めて重要であり、特に以下の疾患を念頭に置く必要がある。
| 鑑別対象疾患 | 鑑別のポイント |
| 双極性障害 | 過去の躁病・軽躁病エピソードの有無を本人および家族から詳細に聴取する。 多弁、活動性亢進、睡眠欲求の減少などを確認する。家族歴も重要。 |
| 持続性抑うつ障害(気分変調症) | 2年以上続く慢性の軽度の抑うつ状態。 MDDのような明確なエピソードを形成しないが、MDDを重畳することがある(Double Depression)。 |
| 適応障害 | 明確な心理社会的ストレッサーとの関連があり、ストレッサーの消失後6ヶ月以内に症状が消失する。 症状がMDDの基準を完全に満たす場合はMDDと診断される。 |
| 身体疾患による抑うつ障害 | 甲状腺機能低下症、クッシング病、パーキンソン病、脳血管障害、悪性腫瘍などが抑うつ症状を呈することがある。 身体的診察と検査が必須。 |
| 物質・医薬品誘発性抑うつ障害 | アルコール、中枢神経刺激薬(離脱期)、降圧薬(レセルピンなど)、ステロイド、インターフェロンなどの使用歴を確認する。 |
| 認知症 | 高齢者において、うつ病による認知機能低下(仮性認知症)との鑑別が重要。 「わからない」と答える傾向(うつ病)か、取り繕う傾向(認知症)かなど、応答の質に注目する。 |
| 統合失調症スペクトラム障害 | 気分に一致しない精神病症状、持続的な陰性症状、奇異な思考内容などがあれば疑う。 |
評価尺度:
重症度評価や治療効果判定の客観的指標として用いられる。
- 医師評価式:
- Hamilton Depression Rating Scale (HAM-D):
最も広く使用される評価尺度。17項目版が一般的。 - Montgomery-Åsberg Depression Rating Scale (MADRS):
抗うつ薬の薬効評価に感度が高いとされる。
- Hamilton Depression Rating Scale (HAM-D):
- 自己評価式:
- Beck Depression Inventory-II (BDI-II):
認知症状の評価に重点を置いている。 - Quick Inventory of Depressive Symptomatology-Japanese (QIDS-J):
簡便でDSMの症状項目と対応している。 - Zung Self-Rating Depression Scale (SDS):
身体症状の評価項目も含む。
- Beck Depression Inventory-II (BDI-II):
【6】検査(心理検査・画像・血液)
MDDに特異的な生物学的マーカーは確立されていないが、鑑別診断と全身状態の評価のために各種検査が行われる。
- 血液・尿検査:
全血球計算、生化学(肝・腎機能、電解質、血糖)、甲状腺機能(TSH, fT3, fT4)は必須。必要に応じて、副腎皮質ホルモン(コルチゾール)、ビタミンB12、葉酸などを測定する。 - 画像検査:
- 頭部CT/MRI: 脳腫瘍、脳血管障害、慢性硬膜下血腫など、抑うつを呈しうる器質性脳疾患の除外のために、特に初老期以降の初発例や非典型的な症状を呈する場合に推奨される。
- SPECT/PET: 認知症との鑑別に有用な場合がある。
- 生理学的検査:
- 心電図: 三環系抗うつ薬(TCA)など心毒性のリスクがある薬剤の使用前に必須。
- 脳波: てんかんやせん妄との鑑別に有用。
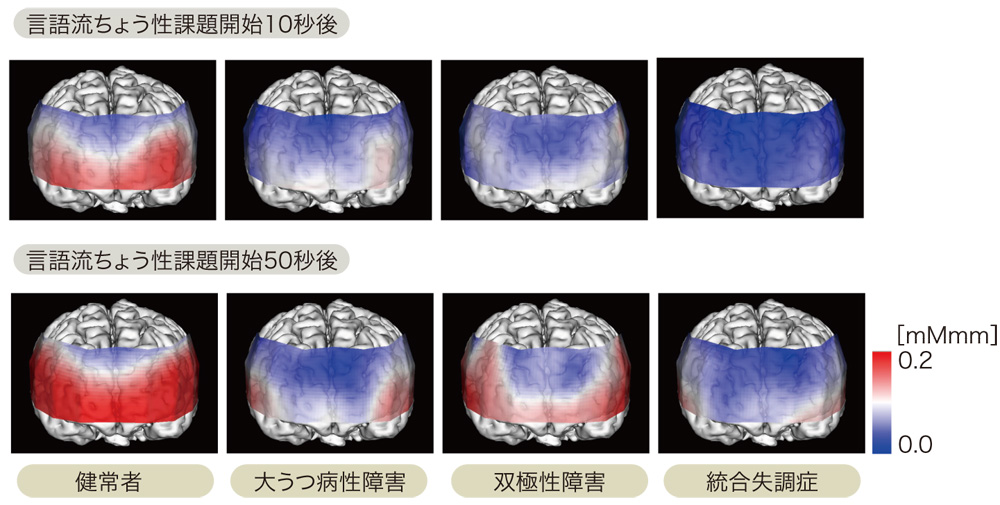
- 光トポグラフィー検査(NIRS):
抑うつ症状の鑑別診断補助として2014年から保険適用。前頭葉の脳血流変化パターンから、うつ病、双極性障害、統合失調症の判別を補助する。感度・特異度は約60-80%。
【7】治療(薬物療法、心理社会的介入、入院適応)
治療は、正確な診断に基づき、重症度、臨床的特徴、併存疾患、患者の意向を考慮して個別化される。治療の目標は症状の寛解(Remission)と機能の回復(Recovery)である。
薬物療法
急性期治療アルゴリズム(日本うつ病学会ガイドライン2024年修正版準拠)
- 第一選択薬:
SSRI, SNRI, NaSSA, S-RIM (ボルチオキセチン) のいずれかを単剤で開始。副作用プロファイル、併存疾患、過去の治療反応性を考慮して選択する。 - 用量調節:
少量から開始し、忍容性を確認しながら4〜6週間かけて有効用量まで漸増する。 - 効果判定:
有効用量で4〜6週間投与しても反応が不十分な場合、以下の選択肢を検討する。- 増量: 最大耐用量まで増量する。
- 切り替え (Switching): 同系統または別系統の第一選択薬に変更する。
- 増強 (Augmentation):
- 非定型抗精神病薬 (AAP): アリピプラゾール、ブレクスピプラゾール、クエチアピン徐放錠などが保険適用。
- 炭酸リチウム: 古典的な増強療法だが、血中濃度モニタリングが必要。
- 甲状腺ホルモン (T3): 特にTCAに対する増強効果のエビデンスがある。
- 併用 (Combination):
異なる作用機序の抗うつ薬を併用する(例:SSRI + ミルタザピン)。エビデンスは限定的であり、副作用に注意が必要。
主な抗うつ薬の作用機序と特徴
| 系統 | 薬剤例 | 主な作用機序 | 特徴 |
| SSRI | エスシタロプラム セルトラリン パロキセチン | セロトニン再取り込み阻害 | 第一選択薬。忍容性良好。 性機能障害、消化器症状に注意。 |
| SNRI | ベンラファキシン デュロキセチン ミルナシプラン | セロトニン・ノルアドレナリン再取り込み阻害 | 疼痛を伴ううつ病にも有効。 血圧上昇、排尿障害に注意。 |
| NaSSA | ミルタザピン | α2自己受容体/ヘテロ受容体遮断 | 鎮静作用が強く、不眠や食欲不振に有効。 体重増加、眠気に注意。 |
| S-RIM | ボルチオキセチン (トリンテリックス®) | セロトニン再取り込み阻害 +セロトニン受容体調節 | 認知機能改善効果が示唆されている。 消化器症状に注意。 |
| TCA | アミトリプチリン イミプラミン クロミプラミン | 5-HT, NA再取り込み阻害。 その他多数の受容体に作用。 | 効果は強力だが、抗コリン作用、心毒性など副作用が多い。 難治例に用いられる。 |
物理療法
修正型電気けいれん療法 (m-ECT)
治療抵抗性、精神病性の特徴、緊張病、切迫した自殺リスク、経口摂取不能な重症例などに極めて有効。短期的な認知機能への影響に注意が必要。

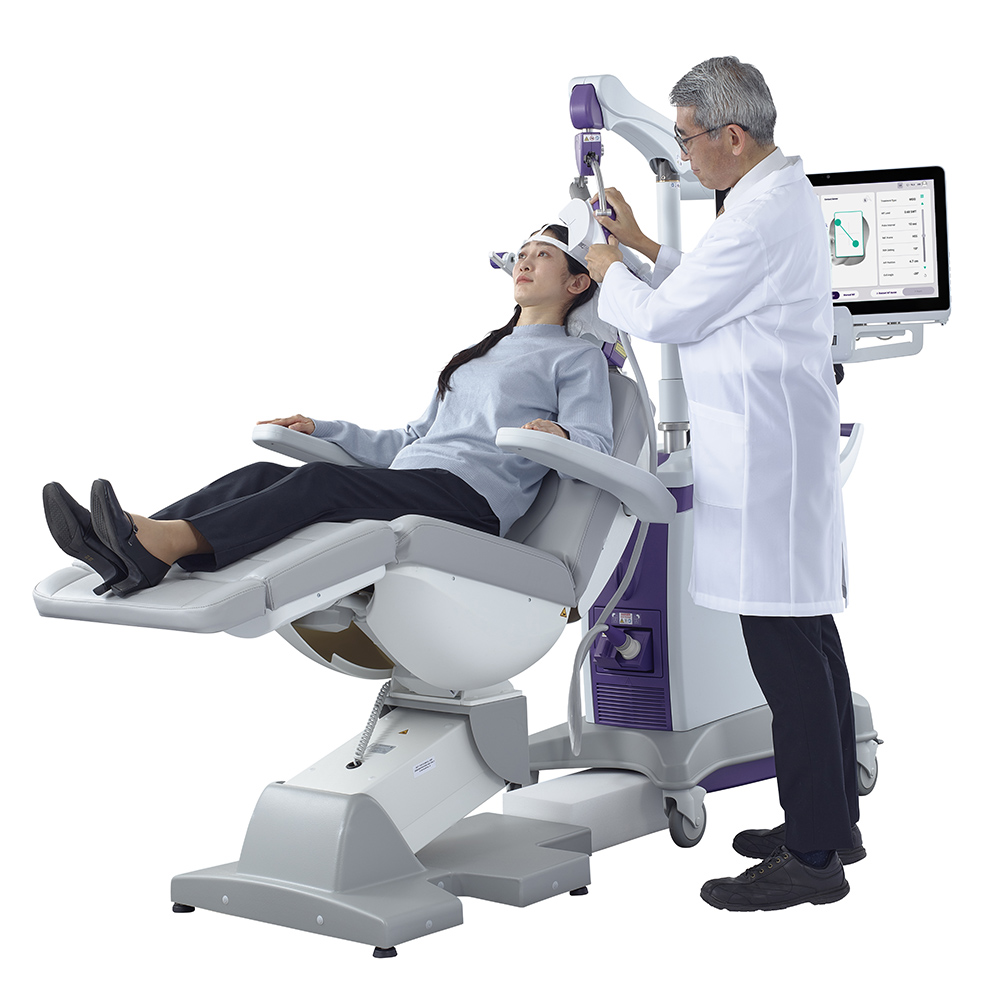
反復経頭蓋磁気刺激 (rTMS)
薬物療法に抵抗性の成人に適応。非侵襲的でECTより副作用が少ない。日本では2019年に保険適用となった。
心理社会的介入
薬物療法と同等の効果が、特に軽症〜中等症で示されており、再発予防効果も高い。
- 認知行動療法 (CBT):
否定的自動思考やスキーマに働きかけ、認知の再構成と行動変容を促す。エビデンスが最も豊富。 - 対人関係療法 (IPT):
「悲哀」「対人関係の役割をめぐる対立」「役割の変化」「対人関係の欠如」の4つの問題領域に焦点を当て、対人関係スキルの改善を図る。 - 行動活性化 (BA):
回避行動を減らし、正の強化をもたらす活動を増やすことに焦点を当てた、CBTから派生した簡潔な治療法。 - 心理教育:
疾患、治療、セルフケアについて情報提供し、治療へのアドヒアランスと自己効力感を高める。すべての治療の基盤となる。
入院適応
- 切迫した自殺のリスク
- 他害の危険
- 精神病症状や緊張病症状が顕著な場合
- 著しい食事摂取不良や身体的衰弱
- 支持的な環境の欠如、または外来治療が困難な場合
- 難治性で、ECTなどの集中的な治療が必要な場合
【8】予後・再発予防(機能予後含む)
MDDは慢性・反復性の経過をたどることが多く、長期的なマネジメントが必要である。
- 予後不良因子:
重症度が高い、精神病性の特徴、不安症やパーソナリティ障害の併存、早期発症、エピソードの頻回な再発、残遺症状の存在、慢性的な身体疾患の併存などが挙げられる。 - 機能的予後:
症状が寛解しても、認知機能障害や社会的機能の低下が遷延することが少なくない。職場復帰には、リワークプログラムなどの専門的な支援が有効な場合がある。 - 再発予防:
- 継続・維持療法:
急性期治療で寛解に至った後も、再発予防のために同量の抗うつ薬を少なくとも6ヶ月〜1年間は継続する(継続療法)。再発リスクが高い患者(3回以上のエピソード、慢性エピソードなど)では、さらに長期の維持療法(1〜3年、あるいはそれ以上)が推奨される。 - 心理療法の活用:
CBTやマインドフルネス認知療法(MBCT)は、薬物療法中止後の再発予防に有効であることが示されている。
- 継続・維持療法:
【9】最新研究動向(過去5年)と今後の展望
- 病態生理:
fMRIを用いた大規模脳ネットワーク研究(特にDMN, SN, CENの相互作用)、ゲノムワイド関連解析(GWAS)によるリスク遺伝子の同定、マイクロバイオーム-腸-脳軸の役割、免疫・炎症系の関与(インフラマソームなど)の研究が活発化している。 - 治療薬開発:
グルタミン酸系を標的とした薬剤(エスケタミン点鼻薬)、GABA作動薬(ブレキサノロン)、オピオイド系調節薬など、従来のモノアミン仮説にとらわれない新規作用機序の薬剤開発が進んでいる。 - 治療法:
- ニューロモデュレーション: rTMSの刺激部位・方法の最適化(例:シータバースト刺激)、集束超音波(FUS)など、より低侵襲で効果的な治療法の開発が進む。
- デジタルセラピューティクス (DTx): スマートフォンアプリを用いたCBTなどが、治療アクセス向上の手段として期待されている。
- 個別化医療:
遺伝子情報、脳画像、臨床データなどを統合したバイオマーカーを探索し、個々の患者に最適な治療法を予測する研究(Precision Psychiatry)が今後の重要な課題である。
【10】国内外ガイドライン比較
| ガイドライン | 特徴 | 軽症うつ病へのアプローチ |
| 日本うつ病学会 (2024改訂) | 実臨床での適用しやすさを重視。 心理教育と治療関係の構築を基本に置く。 薬物療法の選択肢が詳細。 | 心理教育、環境調整、支持的精神療法が基本。 薬物療法は慎重に適応を判断する。 |
| APA (米国精神医学会) | エビデンスに基づき、治療の選択肢を体系的に提示。 薬物療法と心理療法の併用を推奨。 | 心理療法(CBT, IPT)または薬物療法を第一選択肢として同等に推奨。 |
| NICE (英国国立医療技術評価機構) | Stepped-careモデルを提唱。 費用対効果を重視。 | Step 1: 経過観察、心理教育。 Step 2: 低強度の心理社会的介入(ガイド付きセルフヘルプ、CBTベースのグループ療法)。薬物療法は推奨されない。 |
| WHO (世界保健機関) | プライマリケアでの対応(mhGAP)を重視。低・中所得国での適用も視野に入れる。 職場のメンタルヘルス対策ガイドラインも発行。 | 心理社会的介入(行動活性化、対人関係療法など)を推奨。 抗うつ薬は中等症以上で考慮。 |
全体的に、欧米のガイドラインでは軽症例に対する抗うつ薬の第一選択としての位置づけは低く、心理社会的介入を優先する傾向が強い。これは、軽症例における抗うつ薬のプラセボに対する優越性が明確でないというエビデンスを反映している。
【11】参考文献
- American Psychiatric Association. (2022). Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, Text Revision (DSM-5-TR). American Psychiatric Publishing.
- 日本精神神経学会 (日本語版用語監修). (2023). DSM-5-TR 精神疾患の診断・統計マニュアル. 医学書院.
- 永井 良三 (シリーズ総監修), 笠井 清登 (編集). (2021). 精神科研修ノート 第3版. 診断と治療社.
- 井上 令一 (監修). (2022). カプラン臨床精神医学テキスト 第3版. MEDSI.
- 松崎 朝樹 (著). (2020). 精神診療プラチナマニュアル 第3版. MEDSI.
- 大武 陽一 (著). (2018). みんなの心療内科. 中外医学社.
- (2021). こころの病気がみえる vol.1. MEDIC MEDIA.
- 日本うつ病学会治療ガイドライン作成委員会. (2024). 日本うつ病学会治療ガイドライン II.うつ病(DSM-5) 2024年3月1日一部修正.
- World Health Organization. (2022). WHO guidelines on mental health at work.
- Kessler RC, Berglund P, Demler O, et al. (2003). The epidemiology of major depressive disorder: results from the National Comorbidity Survey Replication (NCS-R). JAMA, 289(23), 3095-3105. (PMID: 12813115)
- Kupfer DJ, Frank E, Phillips ML. (2012). Major depressive disorder: new clinical, neurobiological, and treatment perspectives. The Lancet, 379(9820), 1045-1055. (PMID: 22405780)
- Price, R. B., et al. (2024). Salience network occupies a greater proportion of the cerebral cortex in major depression. JAMA Psychiatry.
2